行业动态
纳米酶催化的CRISPR无预扩增检测非编码RNA
-
来源:
海南微氪生物科技股份有限公司
日期:2023-12-28 20:40:46
点击:218
属于:行业动态
纳米酶催化的CRISPR无预扩增检测非编码RNA
1.文献摘要基于CRISPR的诊断能够特异性传感与人类疾病相关的DNA和RNA生物标志物。这是通过将引导RNA与互补序列结合来实现的,该序列激活Cas酶以切割报告分子。目前,大多数基于CRISPR的诊断都依赖于靶标预扩增,以达到临床应用所需的足够灵敏度。这限制了定量能力,并增加了反应化学的复杂性。在这里,研究人员展示了基于 CRISPR-Cas 的反应与纳米酶联免疫吸附测定的结合,该测定允许在室温下通过催化金属纳米颗粒 (CrisprZyme) 对 Cas13 介导的 RNA 检测进行定量和比色读数。研究人员证明 CrisprZyme 很容易适应基于侧向层析的读数和不同的 Cas 酶,并能够感应非编码 RNA,包括 microRNA、长链非编码 RNA 和环状 RNA。研究人员利用这个平台来识别急性心肌梗死患者,并监测前列腺癌患者的体外和组织活检中的细胞分化。研究人员预计CrisprZyme将成为基于CRISPR的诊断的普遍适用的信号催化剂,这将扩大无预扩增定量检测的靶标范围。
2.文献内容
目标RNA与混合grNA–Cas13复合物,并触发报告RNA的侧支切割。随后,将混合物加入预涂有抗-FAM的免疫测定板中。洗去未结合的报告RNA,并加入纳米酶以通过结合的报告RNA形成复合物。最后,添加基质进行显色。在这里,研究人员报道了CrisprZyme的发展,它是基于Cas的反应与纳米酶连接的免疫吸附测定(NLISA)的结合(图1)。
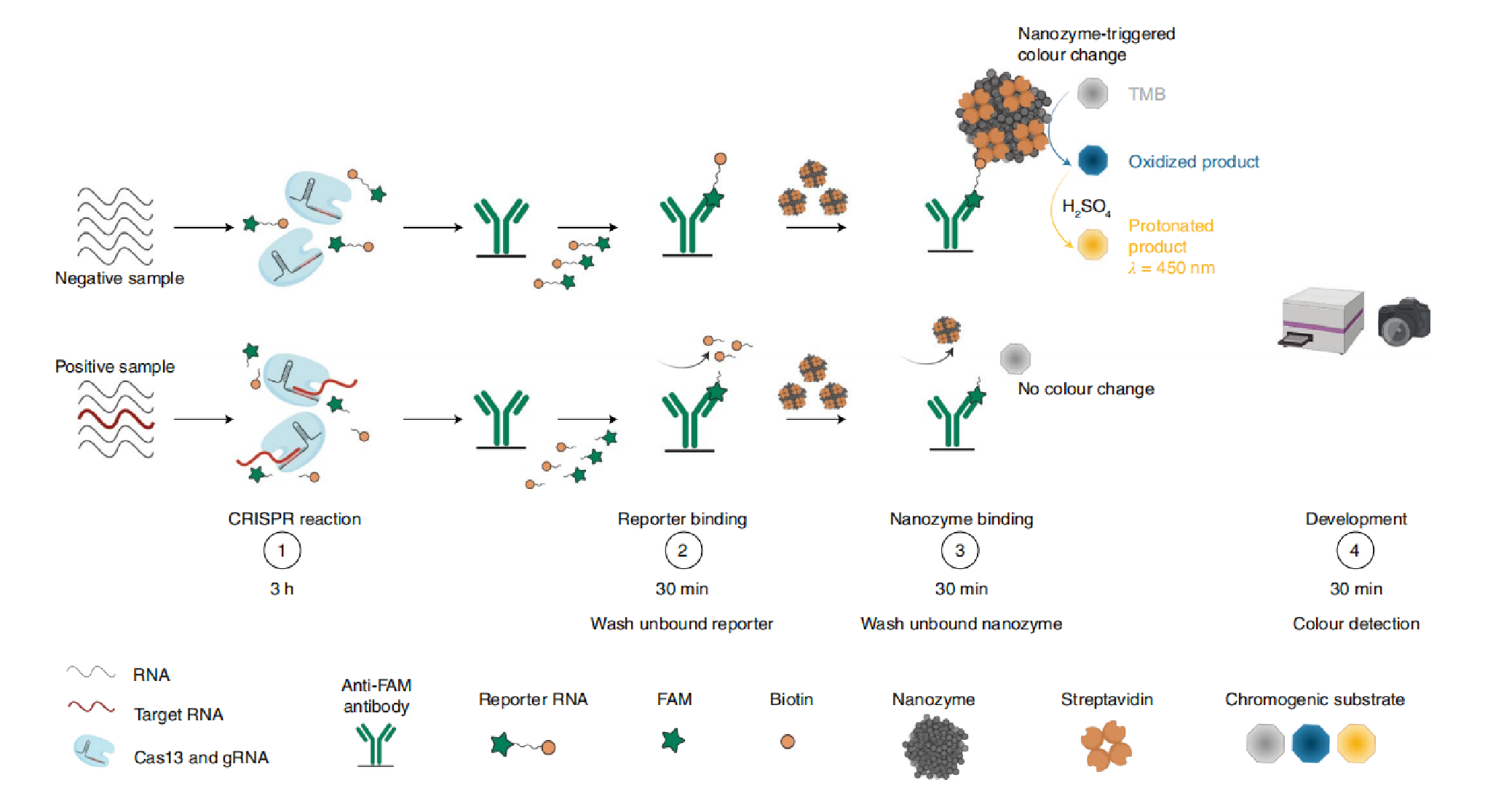
图1|CrisprZyme测定方案
使用15nm金纳米颗粒作为种子,通过种子介导的铂过度生长方法合成了纳米酶,其中聚乙烯吡咯烷酮(PVP)和l-抗坏血酸分别作为铂的稳定剂和还原剂13(图2a);接下来,研究人员旨在通过测试不同的生物素结合蛋白和阻断剂来进一步提高S/N比(图2b);研究人员首先在Au种子上添加不同量的Pt,以制备直径范围从68nm到220nm的颗粒(图2c);研究人员进行二维地层分析,以选择两种抗6-羧基荧光素的最佳浓度滴定测定的目的是在滴定信号达到测定饱和时在平板上获得单层抗-FAM,并获得在吸光度饱和范围外任意选择的~1的吸光度。然后,研究人员确定了最佳报告RNA浓度,使用这些不同的颗粒大小进行测量(图2d);研究人员进行了高角度环形暗场STEM(HAADF-STEM),显示了原子序数对比度,并应用能量色散X射线光谱(EDS)分析了Pt@Au和streptavidin-pt@au(图2f-g)
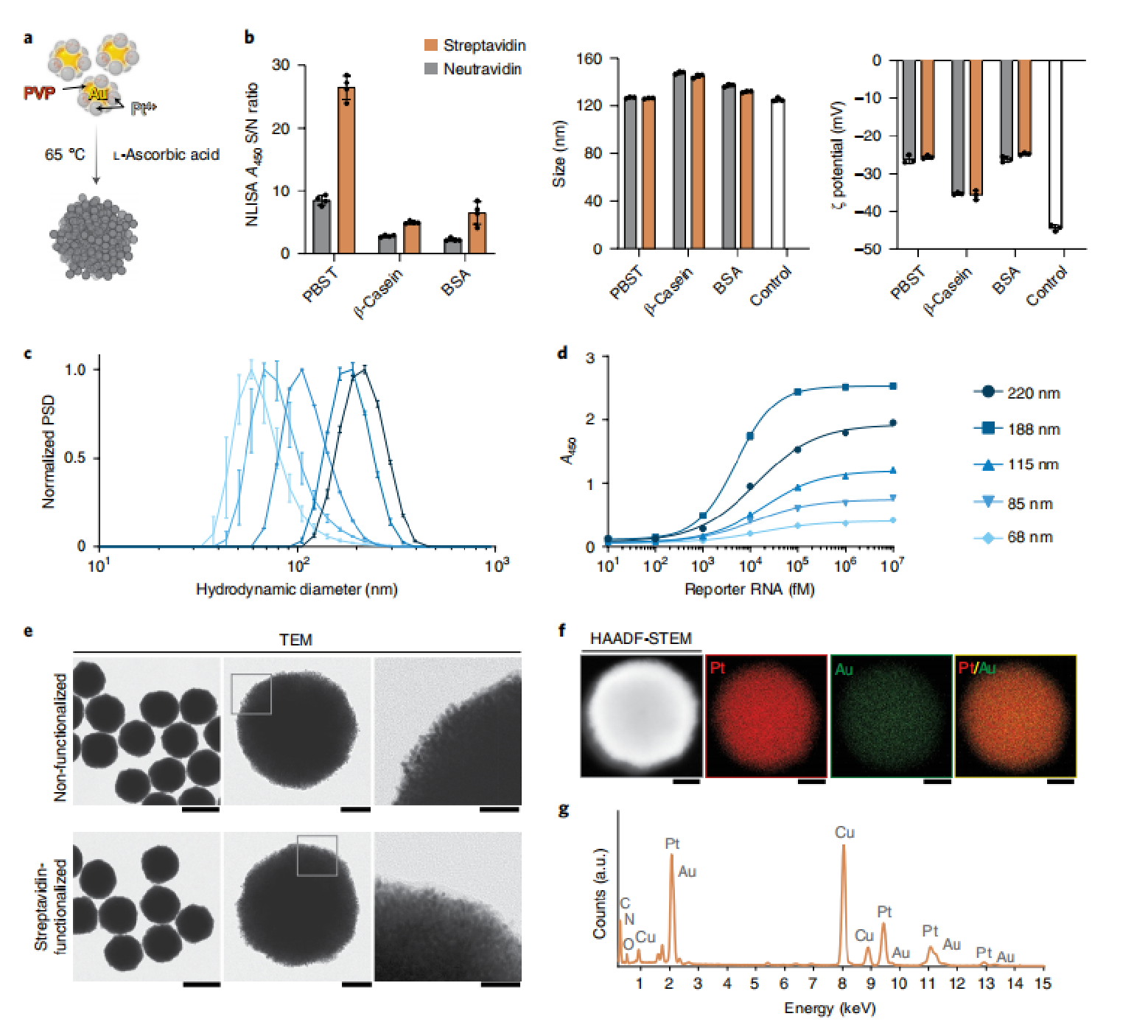
图2|pt@au用链亲和素功能化显示出最佳的NlISA性能
通过测试gRNA与Cas13的不同比例,研究人员发现1.2:1的摩尔比(gRNA:Cas13)将灵敏度进一步提高了10倍。优化的CrisprZyme测定允许通过肉眼观察到指示不同浓度的靶RNA的颜色变化(图第3a);通过测量450 nm处的吸光度(A450),用平板读出器对颜色变化进行量化,结果显示LOD为4.72 pM(图3b,g);而对每个孔的中心像素中的蓝色强度进行图像分析,结果显示出4.89 pM的LOD(图3c,g);重要的是,所有基于LwaCas13a的CrisprZyme测定都在环境温度下完全运行。接下来,研究人员将CrisprZyme用于侧流分析(LFA)的读数(图3d);通过量化使用智能手机拍摄的图像上测试线上的像素密度(图3e),研究人员获得了12.5 pM的LOD(图3f,g)。
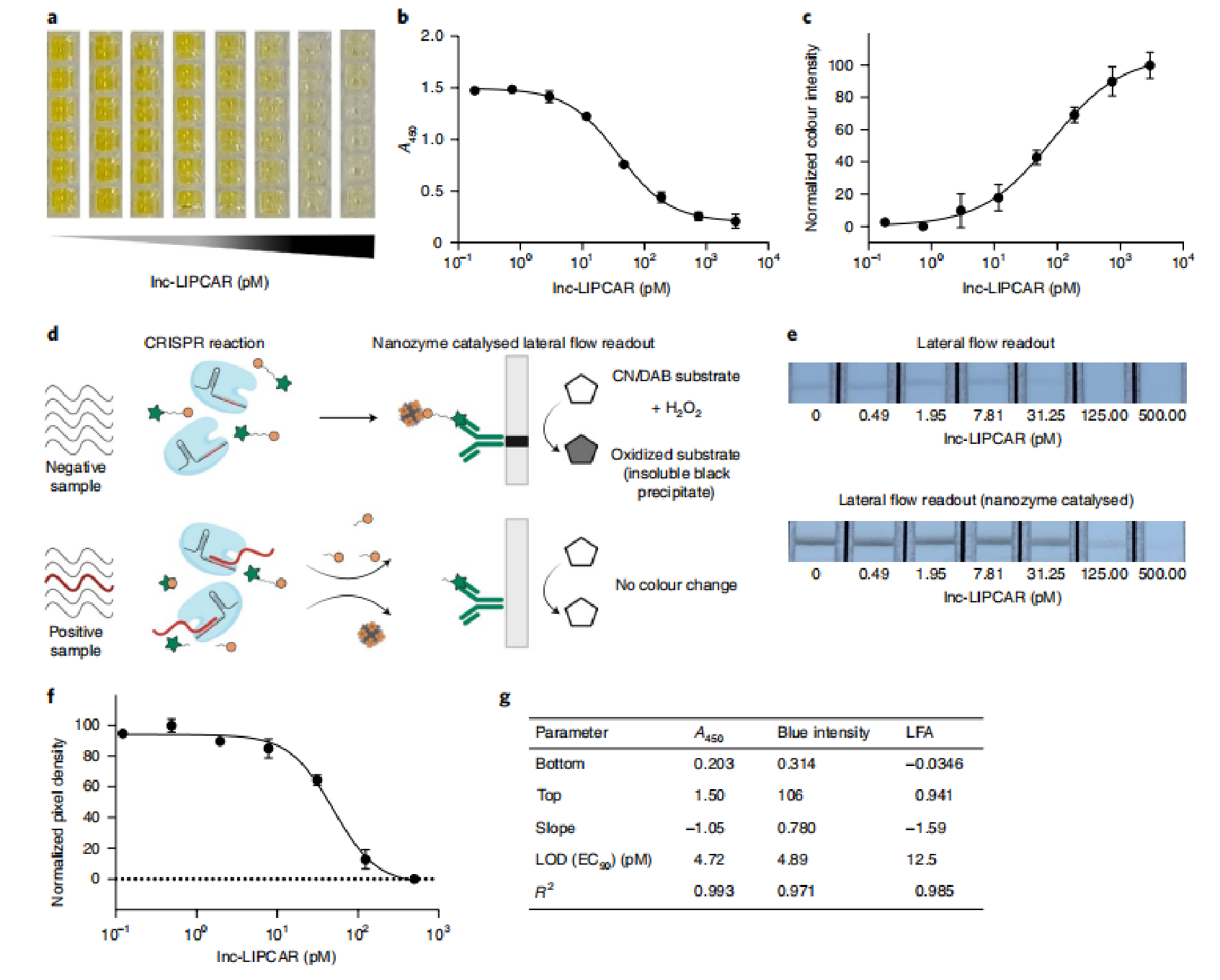
图3|CrisprZyme检测低至皮摩尔浓度的合成RNA。
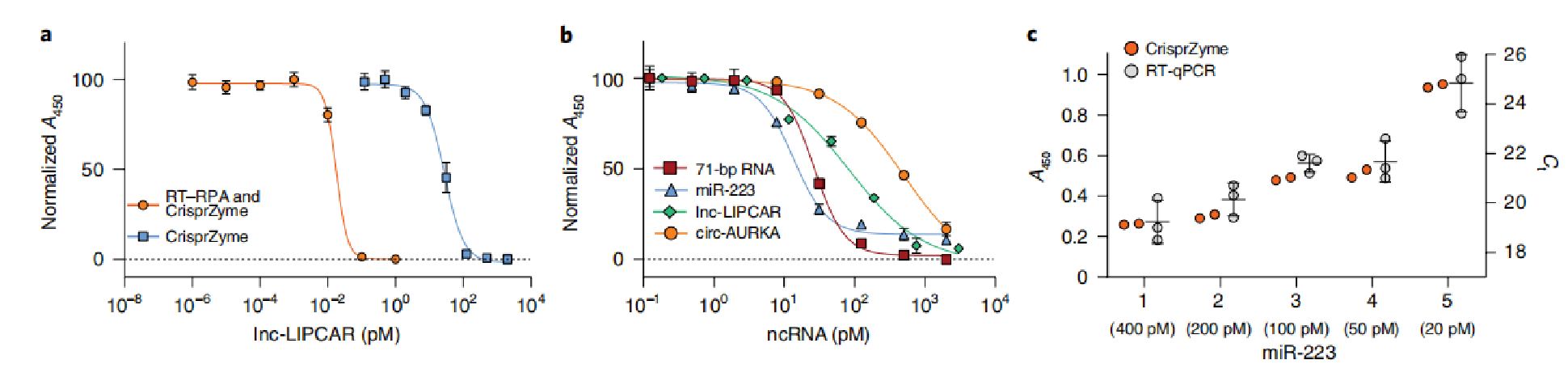
为了进一步评估CrisprZyme的多功能性,研究人员研究了CrisprZyme催化和SHERLOCK技术2中描述的预放大步骤的添加剂组合2。研究人员包括逆转录重组酶聚合酶扩增(RT–RPA),然后是基于T7的RNA转录、Cas13检测和NLISA。这增强了对8.30±0.97fM的LOD的敏感性(图4a);事实上,CrisprZyme能够在皮摩尔范围内定量微小RNA-223(miR-223)、极光激酶A(AURKA)环状RNA和长非编码RNA LIPCAR(lnc LIPCAR)的合成标准物(图4b)为了测试其与已建立的定量诊断测定的相关性,研究人员将CrisprZyme对miR-223的检测与逆转录定量PCR(RT–qPCR)进行了比较(图4c)
为了证明研究人员开发的检测方法的潜在用途,研究人员将其应用于感知不同的人类ncRNA(图5a);由于miRNA的细胞类型特异性表达可以作为细胞命运改变的指标,研究人员旨在通过检测miRNA-143-3p(miR-143-3p)来监测诱导多能干细胞(iPSC)向心肌细胞的体外分化(图5b);CrisprZyme成功在诱导的心肌细胞中检测到miR-143-3p的上调没有前置放大器,这与之前的一致研究23.显示CrisprZyme的诊断潜力对于严重的心肌损伤,研究人员对59名因胸痛到急诊科就诊的患者的血液进行了检测lnc LIPCAR的表达(图5c);研究人员观察到高灵敏度肌钙蛋白T患者的lnc-LIPCAR(hsTnT)高于6pgml−1与水平低于6pgml−1的对照组相比,表明CrisprZyme的识别能力广泛性心肌梗死患者。最后,circRNAs可以在人类疾病中差异表达,从而起到诊断生物标志物24。因此,研究人员旨在区分两种原发性癌症类型:神经内分泌前列腺癌(NEPC)和前列腺腺癌(ACA)的表达环状AURKA RNA(circ-AURKA)。已确定先前作为NEPC24的标记物(图5d)
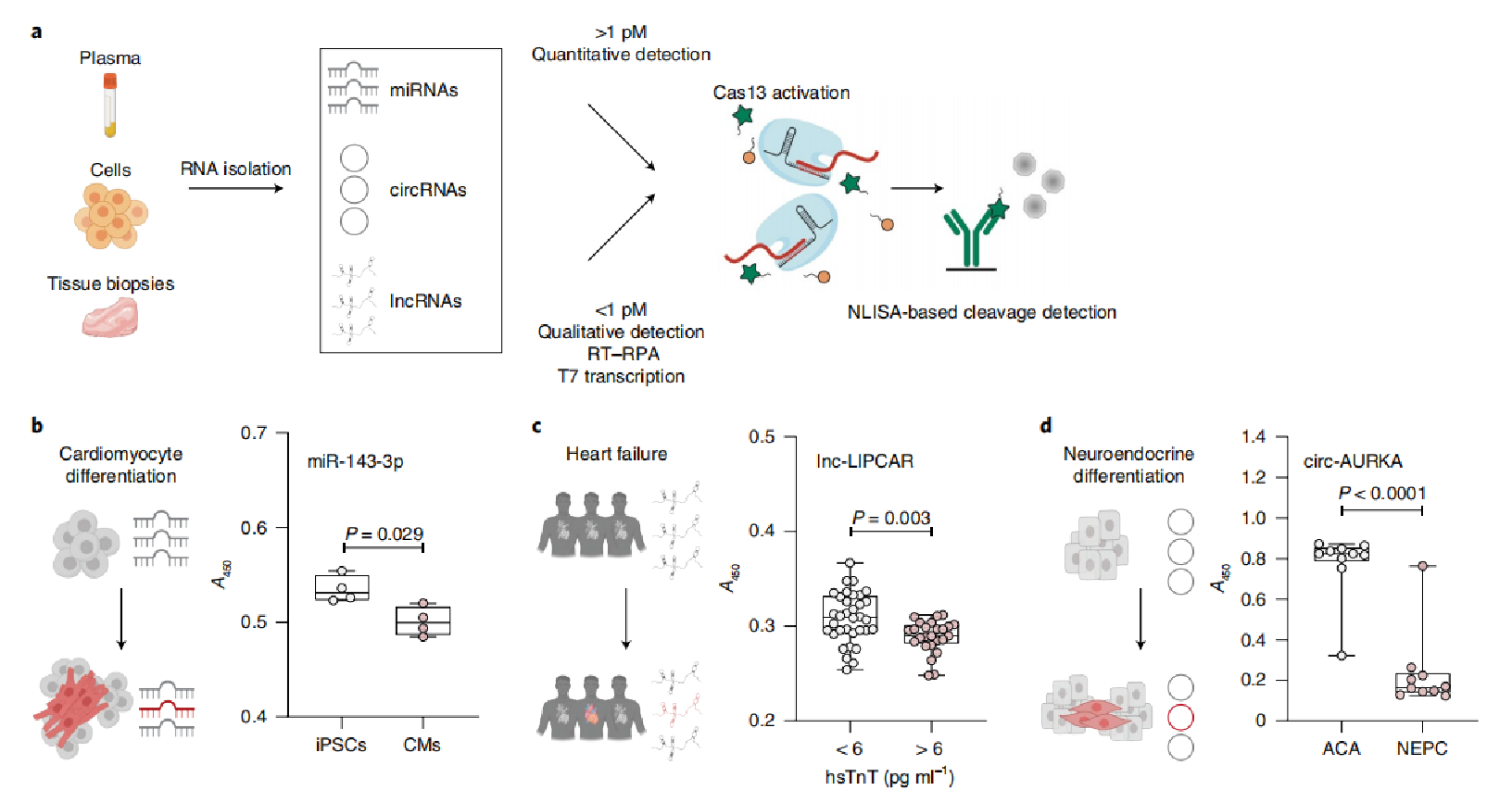
图5|来自细胞培养物和人血浆或组织的不同ncRNA种类的定量。
参考文献:Broto, M., Kaminski, M. M., Adrianus, C., et al. Nanozyme-catalysed CRISPR assay for preamplification-free detection of non-coding RNAs. Nature Nanotechnology, 2022,17(10), 1120-1126.

